都立26理科5、
ドラマ的イオンと化学電池問題。
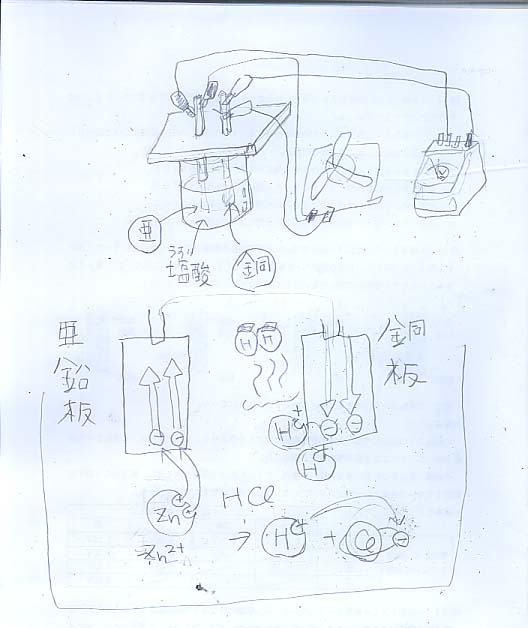
図の薄い塩酸の電離の式からイオンの出来方を考えます。
原子は安定した状態では中性ですが、
それは陽子+とまわりをまわる電子−の数がつり合っているから。
水に溶けると水素原子からは−がひとつ飛び出して水素イオンに、
逆に塩素原子は−をひとつ受けとって塩化物イオンになります。
水素イオンは−がひとつ足りないので陽(+)イオン、
塩化物イオンは-が多いので陰(-)イオンになって、
この成り方は元素の種類によって決まっています。
ちょうどよく男女の数がそろってカップルができていたのに、
ひとり女子がとなりのクラスに行っちゃった。とでもいいましょうか。
しかもそれがクラス一の。
そうすると逃げられたクラスは男子が余った状態になるし、
女子がひとり入ってきたクラスはまた問題が。
ドラマはここから生まれる、というわけです。
さて、そこで図の化学電池の問題。
亜鉛板と銅板では亜鉛板の方が塩酸に溶けやすい。
亜鉛イオンになって溶けるときに−をふたつ残していきます。
その電子が導線を伝わって銅板の方向に向かうのが電子の流れ。
この反作用の逆方向の力が電流の向きです。
銅板にたどりついて−の電子はたまり、
それを水槽の中に溶けている女子の、
もとい電子のたりない陽イオン(水素イオン)がもらいにきて水素原子になり、
それがふたつくついてH2(気体の水素)になって発生する、というわけです。
実験の結果から亜鉛板と亜鉛板、銅板と銅板など同じ金属を使っても電流は流れません。
塩酸に溶ける度合いのギャップが大きいほど流れる量は多くなります。
ギャップが大事。これもドラマの基本ですね。
理科4(3)まるとしわへもどる
都立入試を解いてみた。のトップページへ
表紙に戻る