僀僆儞偲偄偆尵梩偼傛偔暦偔偗傟偳
丂僀僆儞壔徬悈丄傾儖僇儕僀僆儞悈丄塸夛榖偺僀僆儞乮偙傟偼娭學側偐偭偨乯丒丒丒擔忢惗妶偱傕偗偭偙偆傛偔暦偐傟傞尵梩偩偗傟偳丄偦傟偠傖偁僀僆儞偭偰壗丠偲栤傢傟傞偲側偐側偐摎偊傞偺偼傓偢偐偟偄丅
丂偦偙偱僀僆儞偺愢柧偩偑丄嫵壢彂偱偼師偺傛偆偵側偭偰偄傞丅
丂墫巁偼丄墫壔悈慺偑悈偵梟偗偰偄傞丅偙傟傪偔傢偟偔挷傋傞偲丄悈慺尨巕偼亄偺揹婥丄墫慺尨巕偼亅偺揹婥傪偍傃偰悈偺拞偵嶶傜偽傝丄帺桼偵摦偄偰偄傞丅
丂偙偺傛偆側揹婥傪偍傃偨尨巕偺偙偲傪僀僆儞偲偄偆丅亄偺揹婥傪偍傃偨尨巕傪梲僀僆儞丄亅偺揹婥傪偍傃偨尨巕傪堿僀僆儞偲偄偆丅
仢尨巕偲僀僆儞偺偪偑偄
嘆尨巕丗偡傋偰偺尨巕偼偦偺拞偵亄偺揹婥偲亅偺揹婥傪傕偭偰偄傞丅亄偺揹婥偲亅偺揹婥偺検偼摍偟偔丄尨巕慡懱偲偟偰偼揹婥傪偍傃偰偄側偄丅
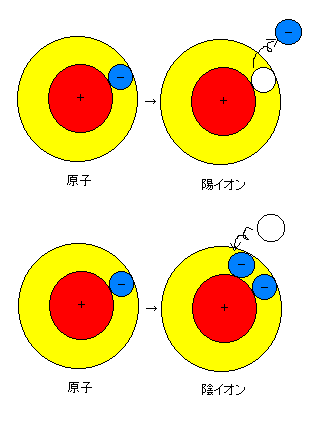
嘇梲僀僆儞丗尨巕偐傜亅偺揹婥傪傕偭偨揹巕偑偼側傟傞偲丄巆偭偨尨巕偼亄偺揹婥傪偍傃傞丅
嘊堿僀僆儞丗尨巕偑揹巕傪庴偗偲傞偲丄尨巕偼亅偺揹婥傪偍傃傞丅
仢僀僆儞傪婰崋偱昞偡
丂僀僆儞偺婰崋偼丄尨巕偺婰崋偺塃忋偵偦偺僀僆儞偑偍傃偰偄傞揹婥偺晞崋傪彫偝偔彂偄偰昞偡丅
乮乽拞妛峑棟壢侾暘栰壓乿戝擔杮恾彂斉傛傝乯
丂偙傟傪偙偠傑幃偱夝愢偟偰傒傞偲師偺傛偆偵側傞丅
嘆抝巕偲彈巕偑摨偠悢偩偗偄傞僌儖乕僾偲偟偰峫偊偰傒傞偲丄傒傫側儁傾儁傾偵側偭偰偄偰傂偲傝偩偗偲偄偆恖偼偄側偄丅偮傑傝亄偲亅偑偮傝崌偭偰偄偰慡懱偱偼僾儔僗偱傕儅僀僫僗偱傕側偄丄揹婥傪偍傃偰偄側偄忬懺偲偄偆偙偲偱偁傞丅
嘇偙偺傒傫側儁傾儁傾僴僢僺乕側僌儖乕僾偐傜彈偺巕偑傂偲傝旘傃弌偟偪傖偭偨偲偡傞偲丄抝偑傂偲傝偁傑偭偰偟傑偆偙偲偵側傞丅偙傟偑偮傑傝亄偺揹婥傪偍傃偨梲僀僆儞偲偄偆忬懺偱偁傞丅
嘊媡偵僌儖乕僾偵奜偐傜彈偺巕偑傂偲傝擖偭偰偔傞偲丄崱搙偼彈偺巕偑傂偲傝偁傑偭偨忬懺偱丄偙傟偑亅偺揹婥傪偍傃偨堿僀僆儞偺忬懺偱偁傞丅
丂墫壔悈慺傗墫壔摵偺傛偆偵丄暔幙偑悈偵梟偗偰梲僀僆儞偲堿僀僆儞偵暘偐傟傞偙偲傪揹棧偲偄偆丅
墫壔悈慺仺悈慺僀僆儞乮梲僀僆儞乯亄墫壔暔僀僆儞乮堿僀僆儞乯
墫壔摵丂仺摵僀僆儞乮梲僀僆儞乯丂亄墫壔暔僀僆儞乮堿僀僆儞乯
丂墫壔暔僀僆儞偑偳偪傜偵傕偁偭偰丄偦傟偑椉曽偲傕堿僀僆儞偵側偭偰偄傞丅偙傟偼梲僀僆儞偵側傞偐堿僀僆儞偵側傞偐偲偄偆偺偼尨巕偺庬椶偵傛偭偰寛傑偭偰偄偰偄傞偐傜偱偁傞丅
梲僀僆儞偵側傞傕偺乮悈慺僀僆儞丄摵僀僆儞丄儅僌僱僔僂儉僀僆儞丄嬧僀僆儞側偳偺嬥懏宯乯
堿僀僆儞偵側傞傕偺乮墫壔暔僀僆儞丄悈巁壔暔僀僆儞丄棸壔暔僀僆儞側偳乯
丂梲僀僆儞偵側傞傕偺偱傕悈慺偼昁偢亅偺揹婥傪傕偭偨揹巕偑傂偲偮偼側傟偰悈慺僀僆儞偵側傞偟丄摵偼傆偨偮偼側傟偰摵僀僆儞偵側傞偲偄偆傛偆偵側傝曽偼庬椶偵傛偭偰偪偑偆丅彈偺巕偵摝偘傜傟傞僌儖乕僾偳偆偟偱傕摵偺曽偑傛傝傕偰側偄僌儖乕僾偲峫偊傞偙偲偑偱偒傞丅乮斶乯
丂
曗懌愢柧丗尨巕偲偄偆偺偼亄偺揹婥傪傕偭偨梲巕偺傑傢傝傪亅偺揹婥傪傕偭偨揹巕偑傑傢偭偰偄傞偲偄偆峔憿偲偄偆偙偲偵側偭偰偄偰丄梲僀僆儞偵側偭偨傝堿僀僆儞偵側偭偨傝偲偄偆偺偼偡傋偰揹巕乮亅乯偑堏摦偡傞偙偲偵傛偭偰偍偙傞丅
丂偦偆偄偆傕偺偱偡丅
師傊
拞妛惗偺儁乕僕偵傕偳傞
偼偠傔偺儁乕僕偵傕偳傞
